3일 미국 증권거래위원회에 따르면 2026년 2월 3일, 레플리뮨그룹(나스닥: REPL)은 2025년 12월 31일로 종료된 회계년도 3분기 재무 결과를 발표하고 기업 업데이트를 제공했다.
회사의 생물학적 제품 허가 신청(BLA) 재제출이 2025년 10월 FDA에 의해 수락되었으며, 처방약 사용자 수수료법(PDUFA) 목표 조치일은 2026년 4월 10일로 설정되었다.상업적 준비 활동이 승인될 경우를 대비하여 잘 진행되고 있다.
회사는 허큘리스 캐피탈과 기존 대출 계약을 수정했으며, 수정안에는 마감 시 3,500만 달러를 인출하고 승인 후 이정표에 따라 추가로 1억 2,000만 달러를 인출할 수 있는 가능성이 포함되어 있다.
또한, 2026년에서 2027년으로 부채 상환이 연기되었으며, 회사는 2027년 1분기까지 현금 유동성을 연장했다.
Sushil Patel 박사는 "우리는 RP1의 BLA 재제출에 대한 FDA와의 검토에 참여하고 있다. 진행된 흑색종 환자들은 빠르게 진행될 수 있으며 안전하고 효과적인 치료 옵션이 절실히 필요하다. 우리 팀은 FDA 승인을 가정하고 RP1을 신속하게 출시할 준비가 되어 있다"고 말했다.
RP1(부솔리모겐 오더파렙벡)의 프로그램 하이라이트 및 이정표로는 IGNITE-3 확인 연구가 있으며, 이 글로벌 3상 시험은 약 400명의 환자를 등록하고 RP1과 니볼루맙의 조합을 평가하고 있다. 이 시험의 주요 목표는 전체 생존율이며, 주요 2차 목표는 무진행 생존율과 전체 반응률이다.
최근 ESMO Congress 2025에서 RP1과 니볼루맙의 조합에 대한 데이터가 발표되었으며, RP1과 니볼루맙의 조합 치료는 객관적 반응률(ORR) 44%를 기록했다. 안전성 프로필은 일반적으로 일시적인 1등급 및 2등급 치료 관련 부작용으로 긍정적이었다.
RP1과 니볼루맙의 조합은 여러 고급 비흑색종 피부암(NMSC) 종양 유형에서 반응을 보였으며, ORR은 각각 100.0%, 33.3%, 66.7%, 56.3%였다. RP1 단독 요법은 34.6%의 ORR을 보였으며, 2년 반응 지속 기간은 61.0%였다.
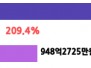
2025년 12월 31일 기준으로 현금, 현금성 자산 및 단기 투자액은 2억 6,910만 달러로, 2025년 3월 31일 기준 4억 8,380만 달러에서 감소했다. 이는 회사의 임상 개발 계획을 추진하는 운영 활동과 관련된 현금 소모로 인한 것이다.
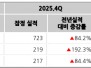
현재 운영 계획에 따르면, 회사는 기존 현금, 현금성 자산 및 단기 투자가 2027년 1분기까지 운영 자금을 지원할 수 있을 것으로 보고 있다. 연구 및 개발 비용은 2025년 회계년도 3분기에 5,310만 달러였으며, 2024년 회계년도 3분기에는 4,800만 달러였다. 이 증가는 IGNITE-3 확인 연구와 관련된 RP1 직접 연구 비용 증가로 인한 것이다.
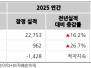
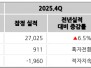
판매, 일반 및 관리 비용은 2025년 회계년도 3분기에 1,870만 달러로, 2024년 회계년도 3분기에는 1,800만 달러였다. 2025년 회계년도 3분기 순손실은 7,090만 달러로, 2024년 회계년도 3분기에는 6,630만 달러였다.
현재 레플리뮨그룹의 재무 상태는 현금 및 현금성 자산이 2억 6,910만 달러로, 운영 자금이 2027년 1분기까지 지속될 것으로 예상된다. 그러나 연구 및 개발 비용이 증가하고 있으며, 순손실이 지속되고 있어 향후 재무 안정성에 대한 우려가 존재한다.
※ 본 컨텐츠는 AI API를 이용하여 요약한 내용으로 수치나 문맥상 요약이 컨텐츠 원문과 다를 수 있습니다. 해당 컨텐츠는 투자 참고용이며 투자를 할때는 컨텐츠 원문을 필히 필독하시기 바랍니다. 원문URL(https://www.sec.gov/Archives/edgar/data/1737953/000110465926009510/0001104659-26-009510-index.htm)
데이터투자 공시팀 pr@datatooza.com
[알림] 본 기사는 투자판단의 참고용이며, 이를 근거로 한 투자손실에 대한 책임은 없습니다.
< 저작권자 ⓒ 데이터투자, 무단 전재 및 재배포 금지 >