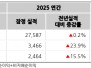
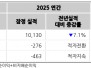
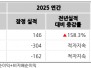
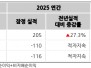
12일 미국 증권거래위원회에 따르면 2026년 2월 12일, 애노비스 바이오(증권코드: ANVS)는 알츠하이머병(AD) 및 파킨슨병(PD)과 같은 신경퇴행성 질환을 위한 경구 치료제인 buntanetap의 임상 3상 시험 진행을 위한 독립적인 데이터 및 안전성 모니터링 위원회(DSMB)의 긍정적인 권고를 발표했다.
DSMB는 6개월 동안의 buntanetap의 안전성에 대한 긍정적인 평가를 내리며, 현재 진행 중인 임상 3상 AD 시험을 수정 없이 계속 진행할 것을 지원했다.
DSMB는 주기적으로 축적된 안전성 데이터를 검토하고 연구의 진행 및 수행에 대한 독립적인 권고를 제공하는 역할을 한다.
애노비스는 공개 세션에서 시험 상태, 등록 진행 상황, 부작용 및 연구 일정에 대한 개요를 발표했다.
비공식 세션에서는 DSMB 투표 회원만 참석하여 완전한 객관성을 보장하고, 비공식 보고 통계학자가 안전성 데이터를 검토했다.
종합적인 평가 후, DSMB는 안전성 문제를 발견하지 못했으며, 임상 시험이 계획대로 계속 진행될 것을 권장했다.
또한, 알츠하이머 환자에서의 6개월 안전성 데이터는 같은 시점에서 파킨슨 환자에서 관찰된 데이터와 일치했다.이후 안전성 평가는 12개월 및 18개월에 계획되어 있다.
애노비스의 마리아 마체치니 박사는 "DSMB로부터 긍정적인 권고를 받게 되어 기쁘다"고 말했다.
"이 반응은 buntanetap의 안전성 프로필에 대한 우리의 신뢰를 강화하며, 임상 프로그램이 중단 없이 진행될 수 있도록 한다.
특히, 알츠하이머 및 파킨슨 연구에서 안전성 결과가 일치함에 따라 FDA는 향후 NDA 제출 시 통합된 안전성 데이터를 수용할 수 있음을 시사했다." buntanetap의 임상 3상 AD 시험(NCT06709014)은 현재 미국 전역에서 환자를 모집하고 있으며, 현재 40%가 완료된 상태이다.
첫 번째 증상 효능 결과는 2027년 초에 예상되며, 질병 수정 결과는 2028년 초에 기대된다.
애노비스 바이오는 펜실베이니아주 말번에 본사를 두고 있으며, 신경퇴행성 질환인 알츠하이머병 및 파킨슨병 치료제를 개발하는 임상 3상 생명공학 회사이다.
회사의 주요 약물 후보인 buntanetap(구 posiphen)은 APP 및 아밀로이드 베타, 타우, 알파-시뉴클레인, TDP-43 등 여러 신경독성 단백질의 번역을 억제하는 하루 한 번 복용하는 경구 치료제이다.
애노비스는 신경퇴행의 근본 원인을 해결하여 질병 진행을 중단하고 환자의 인지 및 운동 기능을 개선하는 것을 목표로 한다.
더 많은 정보는 www.annovisbio.com을 방문하거나 LinkedIn, YouTube, X에서 팔로우하면 된다.
투자자들은 https://www.annovisbio.com/email-alerts에서 이메일 알림을 등록하여 보도 자료 및 산업 업데이트를 받을 수 있다.
애노비스 바이오의 연락처는 101 Lindenwood Drive, Suite 225, Malvern, PA 19355이며, 웹사이트는 www.annovisbio.com이다.
투자자 연락처는 알렉산더 모린 박사, 전략 커뮤니케이션 이사, 애노비스 바이오, ir@annovisbio.com이다.
※ 본 컨텐츠는 AI API를 이용하여 요약한 내용으로 수치나 문맥상 요약이 컨텐츠 원문과 다를 수 있습니다. 해당 컨텐츠는 투자 참고용이며 투자를 할때는 컨텐츠 원문을 필히 필독하시기 바랍니다. 원문URL(https://www.sec.gov/Archives/edgar/data/1477845/000110465926013948/0001104659-26-013948-index.htm)
데이터투자 공시팀 pr@datatooza.com
[알림] 본 기사는 투자판단의 참고용이며, 이를 근거로 한 투자손실에 대한 책임은 없습니다.
< 저작권자 ⓒ 데이터투자, 무단 전재 및 재배포 금지 >